10 يناير 2017
استطاعت العلاجات الكيميائية أن تُسهِم إلى حد كبير في زيادة نسب النجاة من السرطان. لكنّ هذه العلاجات كثيراً ما تسبب آثاراً جانبية خطرة بسبب عدم قدرتها على التمييز بين الخلايا السرطانية والخلايا السليمة. البحوث التي تسعى إلى تقليل هذه الآثار الضارة مهمة من أجل ضمان التزام المرضى بالعلاج وتحسين جودة حياتهم.
يعمل خير الدين البوبو -أخصائي الكيمياء الحيوية النانوية- منذ عشرة أعوام على تصميم جُسيمات نانوية تدمج بين القدرة العلاجية والتشخيصية، وتُعرف أيضاً باسم ’التشخيصية-العلاجية‘. في دراسة حديثة نُشرت في مجلة الكيمياء المترافقة حيوياً ‘Bioconjugate Chemistry’. يصف البوبو وفريقه في جامعة الملك سعود بن عبد العزيز للعلوم الصحية، وفي مركز الملك عبد الله العالمي للأبحاث الطبية التابع للشؤون الصحية بوزارة الحرس الوطني في السعودية، كيف تستطيع الجُسيمات النانوية الفلوريسنتية المغناطيسية المبتكرة، نقل الدواء المضاد للسرطان إلى خلايا سرطان الثدي، بانتقائية فائقة.
أظهرت الجُسيمات النانوية المركبة من الأكسيد المعدني المغناطيسي آمالاً كبيرة لتشخيص الأمراض، كعامل تبايُن للرنين المغناطيسي من ناحية وكعامل لنقل الدواء من الناحية الأخرى. إلّا أنّه من الصعب للغاية إنتاج هذه الجُسيمات للاستخدام في التطبيقات السريرية على نطاق واسع.
من ثَم طوّر باحثون بقيادة البوبو أسلوباً فريداً لإنتاج الجُسيمات النانوية من الأكسيد المعدني المغناطيسي بسهولة وبأسعار رخيصة وبأمان. تتيح المنهجية الجديدة للباحثين -وتُدعى ’الترسيب الأساسي المتحلل بالماء‘ (Ko-precipitation Hydrolytic Basic- KHB)- توليف جُسيمات يتراوح حجمها بين 2-و 6 نانومترات من مواد أولية غير سامة ومتوفرة بسهولة وبأسعار معقولة، وذلك عند 80 درجة مئوية، وتُعَد أقل بكثير من التقنيات الحرارية المُتبعة اليوم والتي تتطلب ما بين 200-إلى 300 درجة مئوية. يوضح البوبو أنه مع استخدام التغليف المناسب لتلك الجسيمات المتولدة، سيصبح بالإمكان استخدامها على نطاق واسع في تطبيقات الطب الحيوي، مثل تشخيص الأمراض والمساعدة في التوصيل المستهدف للأدوية.
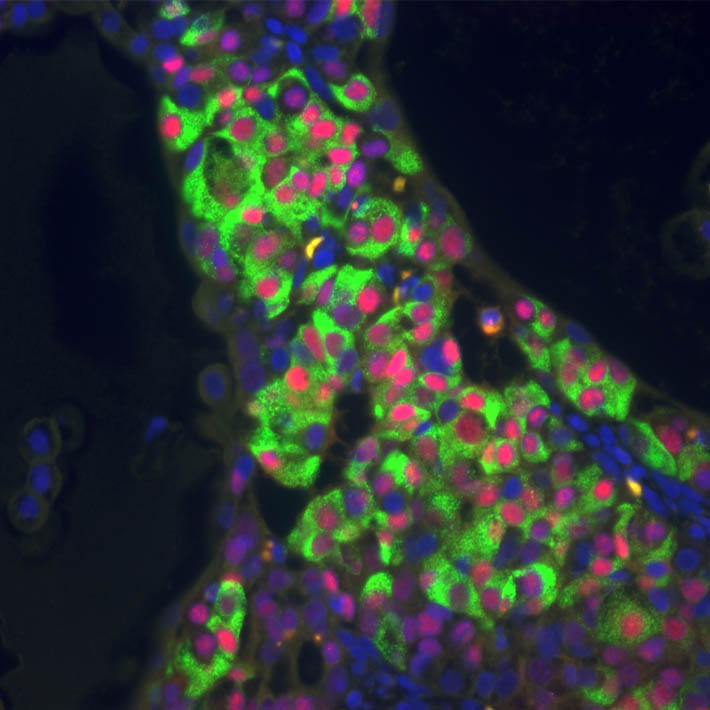
عندما حمَّل الباحثون الجُسيمات التي ابتكروها بالعلاج الكيميائي دوكسوروبيسين، وقيّموا تأثيراته على نوعين من الخلايا السرطانية في سرطان الثدي وعلى خلايا سليمة، فاقت النتائج التوقعات. إذ لم تكن الجُسيمات المُحمّلة بالدواء فعّالة أكثر من دوكسوروبيسين الحر فحسب، إنّما الأهم من ذلك، أنّ تأثير الدواء على الخلايا السرطانية كان أكبر من تأثيره على الخلايا غير السرطانية.
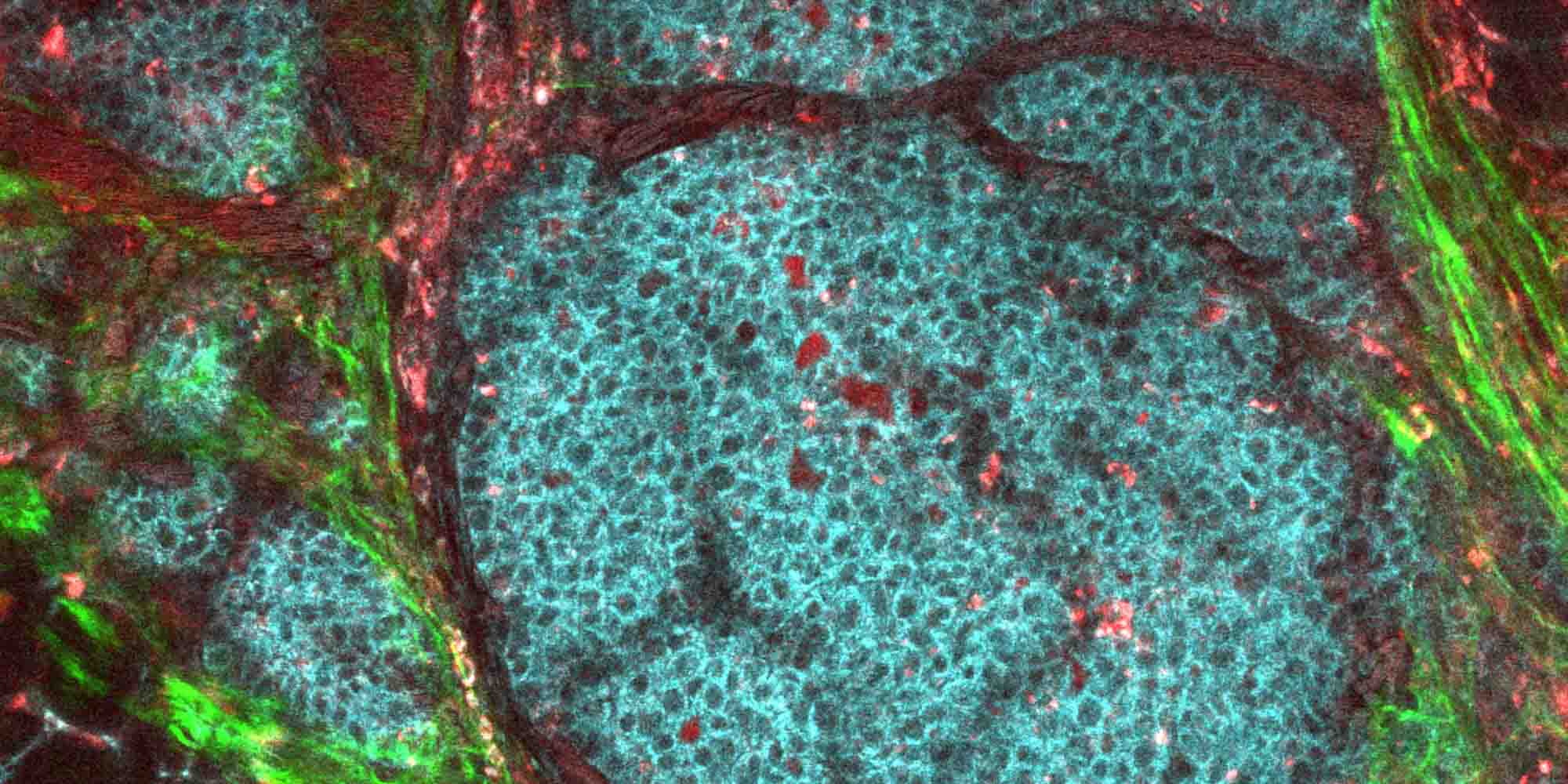
بفضل السمات الفلوريسنتية والمغناطيسية للجُسيمات، استطاع الباحثون إجراء تصوير إلكتروني لتلك الجُسيمات المُحمّلة بالدواء وعرض امتصاص الخلايا للدواء، حتى في أنسجة الورم المأخوذة من مرضى مصابين بسرطان الثدي. خلافاً للدوكسوروبيسين الحر، الذي يدخل الخلية عبر عملية انتشار غير فعالة (سلبية) من خلال الغشاء الخلوي، اختلف الأمر مع الجُسيمات النانوية المحملة بالدواء؛ إذ حثّت على عملية الالتقام الخلوي أو البلعمة، وهي العملية التي يحدث فيها التهام ذاتي للخلايا.
إنّ قدرة هذه الجُسيمات على نقل عقار العلاج الكيميائي للخلايا السرطانية بانتقائية، أمر مدهش إلى حد ما. مع العلم أنّها لم تُصمَّم ضد هدف جزيئي في هذه الخلايا. يقول البوبو: "تشير هذه النتائج إلى أنّه عند وجود نظام توصيل جيد التصميم، بالإمكان تعزيز الاستجابة السُّمِّيَّة [في الخلايا السرطانية]، حتى مع وجود استهداف غير فعال".
References
El-Boubbou, K., Ali, R., Bahhari, H. M., AlSaad, K. O., Nehdi, A., et al. Magnetic fluorescent nanoformulation for intracellular drug delivery to human breast cancer, primary tumors, and tumor biopsies: Beyond targeting expectations. Bioconjugate Chemistry. (2016).| article